
[마이데일리 = 이호빈 기자] 미국 식품의약국(FDA)이 내년부터 신약 허가 심사 수수료를 크게 올리는 대신, 바이오시밀러(바이오의약품 복제약) 수수료를 대폭 낮추기로 했다.
12일 한국바이오협회에 따르면 FDA가 내년 바이오시밀러 심사 수수료롤 인하하기로 결정함에 따라 미국 시장 점유율 확대를 노리는 셀트리온과 삼성바이오에피스 등 국내 바이오시밀러 기업에게 호재가 될 전망이다.
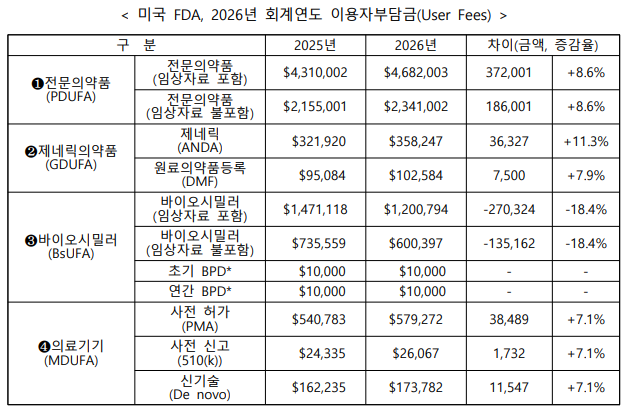
최근 FDA는 최근 신약(전문의약품), 제네릭(복제약), 바이오시밀러, 의료기기 제조기업로부터 받는 2026 회계연도 허가 심사 수수료를 확정해 연방 관보에 게재했다. 매년 물가상승률, 심사 신청 건수, 제조시설 수, 심사 인력 유지비 등을 반영해 ‘이용자부담금’을 책정한다. 2026 회계연도는 오는 10월 1일부터 내년 9월 30일까지 적용된다.
내년 전문의약품 허가 심사 수수료는 468만2003달러(65억원)로, 올해(431만달러, 60억원)보다 8.6% 인상됐다. 제네릭은 11.3%, 의료기기는 7.1% 올랐다.
반면 바이오시밀러 심사 수수료는 147만달러(20억원)에서 120만달러(16억원)로 18.4% 줄였다. 임상자료를 포함하지 않은 바이오시밀러 심사 수수료도 73만달러에서 60만달러로 동일하게 18.4% 낮췄다.
FDA는 내년 전문의약품 심사 프로그램 수를 2971건으로 추정했다. 이 중 156건이 희귀의약품 등으로 수수료 면제를 받을 것으로 예상돼 최종 2815건을 대상으로 수수료를 책정했다. 바이오시밀러 개발 관련 사전 미팅(BPD) 건수는 올해 120건에서 내년 150건으로 증가할 전망이다.
이 같은 조치는 미국 시장에서 점유율 확대를 꾀하는 국내 바이오시밀러 기업에 긍정적인 영향을 미친다.
셀트리온은 현재 미국에서 총 8개 제품을 판매하고 있다. 자가면역질환 치료제는 인플렉트라(인플릭시맙), 짐펜트라(인플릭시맙 피하제형), 유플라이마(아달리무맙), 스테케이마(우스테키누맙) 등 4종, 항암제는 허쥬마(트라스투주맙), 트룩시마(리툭시맙), 베그젤마(베바시주맙) 등 3종, 골질환 치료제는 스토보클로·오센벨트(데노수맙) 1종이다.
셀트리온 관계자는 "현재 개발 중인 파이프라인 대부분이 미국과 유럽 등 글로벌 시장을 겨냥하고 있다"고 설명했다.
삼성바이오에피스는 현재 미국에서 총 10개 바이오시밀러 품목을 허가 받고 이중 6종을 판매 중이다. 자가면역질환 치료제는 렌플렉시스(인플릭시맙), 하드리마(아달리무맙), 피즈치바(우스테키누맙) 등 3종, 항암제는 온트루잔트(트라스투주맙) 1종, 안과 치료제는 바이우비즈(라니비주맙) 1종, 희귀질환 치료제는 에피스클리(에쿨리주맙) 1종이다. 허가를 받은 나머지 4종은 에타너셉트 바이오시밀러 ‘에티코보’, 애플리버셉트 바이오시밀러 ‘오퓨비즈’, 데노수맙 바이오시밀러 ‘오스포미브’, ‘엑스브릭’으로 향후 시장 출시를 준비 중이다.
다만 업계에서는 이번 조치의 실질적 비용 절감 효과가 크지 않을 것이란 시각도 있다.
바이오업계 관계자는 "바이오시밀러 1개 품목을 개발해 상용화하기까지 상당한 시간과 비용이 들어간다"며 "허가 심사 수수료 인하는 긍정적이지만 전체 개발비용에서 차지하는 비중을 고려하면 부담 경감 효과는 제한적일 수 있다"고 평가했다.
또 다른 관계자는 "이번 수수료 조정은 미국 정부가 바이오시밀러 산업을 장려하는 정책 신호로 해석할 수 있다"며 "대부분 매년 소폭 인상되던 허가 수수료가 올해는 큰 폭으로 낮아진 것은 바이오시밀러 시장 진입 기회를 확대하려는 의도로 볼 수 있다"고 덧붙였다.
Copyright ⓒ 마이데일리 무단 전재 및 재배포 금지
--comment--
첫 번째 댓글을 작성해 보세요.
댓글 바로가기